Загальний дизайн дослідження
Ми провели неосліплене кластерне рандомізоване контрольоване дослідження (кластерне РКД), щоб визначити ефективність модифікованого мобільного додатку TaWai в поєднанні з очним навчальним семінаром у порівнянні зі звичайною практикою в поєднанні з тим самим семінаром групи втручання на Повідомлення про побічні реакції в лікарнях Лаоської НДР. Кластер з трьох лікарень третинного рівня в Лаоській НДР був випадковим чином розподілений дослідником у співвідношенні 1:1 або до групи втручання (n = 1 лікарня), або до контрольної групи (n = 1 лікарня). Обидві групи взяли участь у двох сесіях очних навчальних семінарів, кожна тривалістю 2 години, протягом 4-місячного періоду спостереження з липня по жовтень 2022 р. Цей навчальний семінар, який проводив викладач із Лаоської НДР, мав на меті забезпечити щоб знання медичних працівників про побічні реакції не заважало їхньому звітуванню. Він складався з огляду побічних реакцій, моніторингу побічних реакцій, оцінки та звітності; поширені побічні реакції, пов’язані з лікарськими засобами, що застосовуються у хворих на туберкульоз та ВІЛ; та управління цими ADR. Це дослідження було проведено відповідно до рекомендацій належної клінічної практики (GCP) і Гельсінської декларації.
Клінічні умови
Цільовою установкою цього дослідження були всі відділення в двох лікарнях третинного рівня в Лаоській НДР. Проте лише відділи проти туберкульозу та ВІЛ кожної лікарні погодилися взяти участь.
Втручання
Основним втручанням, використаним у цьому дослідженні, був модифікований мобільний додаток TaWai на додаток до вищезгаданих освітніх семінарів. Усі медичні працівники в групі втручання пройшли 30-хвилинний тренінг щодо використання модифікованого мобільного додатку TaWai перед впровадженням цього інструменту для звітування про побічні реакції у своїй лікарні.
КОНТРОЛЬ
Подібно до групи втручання, контрольна група також брала участь у навчальних семінарах. Проте всі лікарі цієї групи продовжували використовувати звичайний інструмент (паперові або комп’ютерні форми) для звітування про побічні реакції у своїй лікарні.
Модифікований мобільний додаток Tawai
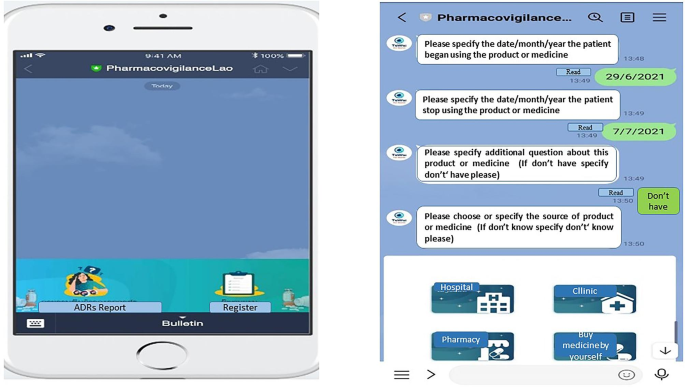
Деталі та необхідна інформація для обох інструментів звітування про побічні реакції наведено в додатковій таблиці 1. Модифікований мобільний додаток TaWai розроблено лаоською мовою з дозволу комітету TaWai for Health Unit у Таїланді. Ця версія була розроблена як чернетка чат-бота для використання на мобільних телефонах. Елементи в цій версії були адаптовані з тайської версії та адаптовані до контексту Лаоської НДР, включаючи національні рекомендації щодо фотоелектричних параметрів, правила звітування про ADR та відповідні закони. Також була включена важлива інформація про побічні реакції, яку вимагає ВООЗ. Змінені розділи являли собою пункти, пов’язані з інформацією про пацієнтів, а також типами та джерелами підозрюваних ліків. Мобільний додаток TaWai складається з чотирьох вимірів звітності про побічні реакції на основі критеріїв ВООЗ: (1) інформація про пацієнта, (2) інформація про побічні реакції, (3) інформація про підозрювані лікарські засоби та (4) інформація про повідомлення. Приклад функцій програми TaWai представлено на рис. 1. Хоча тайська та лаоська мови схожі за розмовною формою, їх системи письма абсолютно різні. Дослідники, які брали участь у модифікації та розробці чат-бота, використовували тайську та лаоську мови у своїй роботі та повсякденному житті, демонструючи своє володіння обома мовами17. Контентну валідність цього інструменту оцінювали три експерти, в тому числі один кандидат наук. клінічної фармації, один к.м.н. в соціальній та адміністративній фармації та керівник центру PV, який також має ступінь доктора філософії. в соціальній та адміністративній фармації. Було підтверджено валідність вмісту всіх елементів у модифікованому проекті чат-бота з індексом валідності вмісту (IOC) один до його впровадження в мобільний додаток.

Приклад мобільного додатку TaWai для звітування про побічні реакції.
Вимірювання результатів
Основними результатами були загальна кількість або частота та якість звітів про побічні реакції, зібраних протягом 4-місячного періоду дослідження. Крім того, задоволеність та знання репортерів були оцінені як другорядні результати. Протягом усього періоду дослідження первинні результати збиралися та оцінювалися щомісяця протягом чотирьох місяців, що призвело до п’яти оцінок, включаючи базову лінію. Знання кожного HCP оцінювали за допомогою опитувальника, який проводили до та після семінару в обох групах, тоді як задоволеність мобільним додатком TaWai оцінювалася лише в групі втручання.
Якість звітів про побічні реакції в цьому дослідженні оцінювали за критеріями ВООЗ1 дослідником. Звіт вважався якісним, якщо він включав усі необхідні пункти відповідно до стандартів ВООЗ. Ключові елементи для якісних звітів про випадки включали: (1) опис побічної реакції або досвіду захворювання, (2) деталі підозрюваних і супутніх лікарських засобів, (3) характеристики пацієнтів, (4) документацію про діагностику реакцій, включаючи методи і (5) клінічний перебіг реакції та наслідки пацієнта, такі як госпіталізація або смерть. Відсутність будь-якого з цих елементів, навіть одного, автоматично класифікує звіти про ADR як низькоякісні1.
Анкета знань складалася з п’яти областей, включаючи визначення побічних реакцій і процесу ПВ, вплив на здоров’я, взаємозв’язок між побічними реакціями та рівнем смертності або витратами, пов’язаними з побічними реакціями, важливість звітування про побічні реакції та загальні побічні реакції, пов’язані з препаратами проти туберкульозу та ВІЛ. Загальна оцінка знань склала 46 балів, причому більший бал свідчить про більші знання. На основі критеріїв оцінювання знань за таксономією Блума18бали були розділені на три рівні: високі знання (≥ 80%, або 37–46 балів), середні знання (60–79%, або 28–36 балів) і низькі знання (≤ 60%, або ≤ 28 балів). ).
Анкета задоволеності була спеціально розроблена для цього дослідження з використанням 5-бальної шкали Лайкерта. Кожен пункт отримав оцінку від 1 (дуже низька задоволеність) до 5 (дуже висока задоволеність). Тест на валідність змісту опитувальників як задоволеності, так і опитувальників знань був схвалений трьома експертами, включаючи одного лікаря-спеціаліста з туберкульозної інфекції (керівник протитуберкульозного відділення), одного лікаря-спеціаліста з ВІЛ-інфекції (головний ВІЛ-відділення) та керівника центру ФВ, який має ступінь доктора філософії. в соціальній та адміністративній фармації. Кваліфікація оцінювача — це люди, які розуміють лаоську мову та працюють, пов’язані з процесом PV або звітністю про ADR у Лаоській НДР.
Учасники
Критерієм включення кластерних одиниць була лікарня третього рівня в Лаоській НДР. Після рандомізації лікарень у групу втручання або контрольну групу, команди медичних працівників (HCP) з усіх відділень кожної рандомізованої лікарні були набрані за допомогою офіційного листа-запрошення, надісланого через керівника кожного відділення. Участь погодилися взяти лише групи медичних працівників з відділень туберкульозу (ТБ) та вірусу імунодефіциту людини (ВІЛ). Медичні працівники віком від 18 років були включені, якщо вони працювали у відділеннях протидії туберкульозу та ВІЛ-інфекції принаймні шість місяців, були залучені до звітування про побічні реакції та були готові брати участь у дослідженні. Медичні працівники були виключені, якщо вони не були знайомі зі смартфоном, планшетом або мобільним пристроєм, на якому можна розмістити програму, не могли розуміти чи писати лаоською мовою або відмовилися брати участь у дослідженні.
Рандомізація
Оскільки це дослідження було розроблено для покращення звітності про побічні реакції медичними працівниками в усіх відділеннях у кожній лікарні, одиницею рандомізації було відділення лікарні, щоб мінімізувати забруднення даних. Згідно з опитуванням дослідників, проведеним у 2022 році, у Лаоській НДР є десять державних лікарень. Однак ми вибрали лише лікарні третинного рівня як кластери для цільового закладу, оскільки цей тип лікарень відіграє ключову роль у звітності про побічні реакції для центру PV у Лаоській НДР. Таким чином, три лікарні третинного рівня були обрані як кластери населення для цього дослідження.
Два етапи рандомізації були виконані дослідником, який не брав участі у наборі та зборі даних. Спочатку дві з трьох лікарень третинного рівня були обрані як вибіркові кластери за допомогою простої випадкової техніки за допомогою комп’ютерного рандомізатора. Потім ці дві лікарні були рандомізовані на групи втручання та контрольну за тією ж методикою. Коди випадкового розподілу були поміщені в запечатані конверти дослідником, який не брав участі в реєстрації чи зборі даних. Дві лікарні були поінформовані про рандомізацію в день візиту для початку випробування. На основі концепції кластерної рандомізації всі відділення в кожній кластерній лікарні були призначені до втручання та контрольної групи відповідно до коду рандомізації для кожної лікарні. Таким чином, для участі в цьому дослідженні було залучено медичних працівників у кожній включеній лікарні третинного рівня, які відповідали критеріям виключення, згаданим вище.
Статистичний аналіз
Аналіз даних проводили за допомогою STATA 15.0. Для всіх аналізів використовувався підхід «намір лікувати». Описову статистику використовували для узагальнення характеристик, задоволеності та знань включених медичних працівників. Для порівняння між групами категоріальні змінні, такі як стать, професія, рівень освіти, загальна кількість звітів про побічні реакції та високоякісні звіти, аналізувалися за допомогою хі-квадрат або точного критерію Фішера. Безперервні змінні, такі як вік, досвід і тривалість роботи, а також оцінки знань аналізувалися за допомогою незалежного t-тесту або U-тесту Манна-Уітні. Були розраховані двосторонні p-значення, причому значення менше 0,05 вважалися статистично значущими. Через обмежену кількість цільової групи (медичні працівники, які беруть участь у звітності про побічні реакції), розмір вибірки не оцінювався. Натомість ми включили всіх медичних працівників у кожен кластер, які відповідали критеріям включення та виключення. Виходячи з цього критерію, приблизно 65 медичних працівників мали право; однак лише 34 медичні працівники висловили бажання взяти участь у дослідженні, і це стало остаточним розміром вибірки. Аналіз підгруп проводили за типом відділення.
Декларація етики та реєстрація випробування
Протокол дослідження було схвалено Університетом Махасаракхам (ID: 115-074/2022) і Національним етичним комітетом Лаосу з питань охорони здоров’я (ID: 065/NECHR). Протокол дослідження було зареєстровано в Реєстрі клінічних випробувань Тайланду (TCTR20220607002, доступний за адресою https://www.thaiclinicaltrials.org/show/TCTR20220607002) 7 червня 2022 р. Однак деякі розбіжності між початковим протоколом дослідження та остаточним звітом наведено в Додаткова таблиця 2. Підсумовуючи, ми відкоригували частоту семінару та тривалість спостереження через пандемію COVID-19. Після завершення сесії семінару ми провели додаткові обговорення з командою та вирішили змінити пріоритетність результатів, перемістивши частоту та якість звітів про побічні реакції від другорядних до первинних, оскільки якість звітів так само важлива, як загальна кількість побічних реакцій. повідомляє, який є початковим первинним результатом. Крім того, кількість повідомлень про побічні реакції еквівалентна загальній кількості повідомлень, але вони відображають різні аспекти повідомлень, тому доцільно перенести їх на первинний результат. Знання медичних працівників спочатку не було заздалегідь визначено як результат дослідження, оскільки метою вимірювань до та після семінару було переконатися, що цей фактор не впливає на кількість або якість звітів. Однак ми вирішили включити його як вторинний результат, щоб забезпечити більшу ясність щодо того, що ми вимірювали в дослідженні. Про це дослідження було повідомлено відповідно до рекомендацій CONSORT, розширених для кластерних рандомізованих контрольованих досліджень (додаткова таблиця 3–4)19,20. Письмова інформована згода була отримана від усіх учасників перед процедурою реєстрації.